Бактериологическое исследование
Для бактериологического исследования берут только живую рыбу, так как у погибшей быстро развивающаяся микрофлора затрудняет выделение возбудителей болезней. При взятии материала соблюдают правила асептики.
Посуду для взятия проб (банки, колбы, пробирки, чашки Петри и др.) предварительно стерилизуют в автоклаве (при 1 атм 20-30 мин) или в сушильном шкафу (при 160-170°С 1-1,5 ч). Ведра, кастрюли, бидоны тщательно промывают теплой водой с мылом, ополаскивают кипяченой водой. Перед взятием живой рыбы посуду заполняют водой из водоема, откуда берут рыбу, или из артезианской скважины. Руки тщательно моют и протирают тампоном, смоченным спиртом.
В лаборатории вначале делают первичные посевы на питательные среды (МПБ и МПА).
Прежде всего исследуют материал, взятый из пораженных участков (язвы, абсцессы и т. п.). Перед взятием соскоба язвы промывают стерильным физиологическим раствором. Содержимое абсцессов набирают пастеровской пипеткой после прижигания шпателем места взятия. Кровь для посевов берут из сердца или хвостовой артерии. Первую каплю крови удаляют, а последующие 2 - 3 высевают на питательную среду.
Вскрывают рыб на пробковых, деревянных или из другого материала досках, предварительно протертых денатурированным спиртом или 3 - 5 %-ным фенолом. Рыбу кладут на правый бок брюшной стороной к вскрывающему и фиксируют препаровальной иглой на доске в области головы и хвоста. Туловище с левой стороны освобождают от слизи и чешуи, удаляют грудной и брюшной плавники, бок и брюшко протирают ватным тампоном, смоченным спиртом.
Осторожно, чтобы не повредить кишечник, прокалывают концом одной из бранш ножниц брюшную стенку выше ануса. Вскрытие начинают с дугообразного разреза вперед и вверх к позвоночнику и далее вперед к жаберной крышке за основание грудного плавника. Пинцетом захватывают брюшную стенку и удаляют, разрезая по средней линии, идущей от анального отверстия до грудных плавников.
Непосредственно перед вскрытием инструменты (скальпель, ножницы, петь: и др.) кипятят в течение 30 мин. Перед взятием материала для, бактериологического исследования их дополнительно смачивают денатурированным спиртом и обжигают на пламени горелки.
Для бактериологического исследования высев на питательные среды делают из сердца, селезенки, почек и других органов. Перед взятием место прокола предварительно обеззараживают нагретым металлическим шпателем. Для взятия крови из сердца органы брюшной полости отодвигают в сторону, освобождают перегородку сердечной полости и оттянутым концом пастеровской пипетки прокалывают сердечную мышцу.
Для идентификации возбудителей бактериальных болезней изучают их o морфологию, подвижность, культуральные, биохимические свойства.
Микроорганизмы можно изучать в живом, фиксированном состоянии, при выделении чистых культур на питательных средах.
Определяют форму, размеры, структуру, подвижность бактерий. Последнее можно установить на полужидком агаре или методом висячей, раздавленной капли.
Для приготовления фиксированного мазка на чистое обезжиренное предметное стекло наносят петлей исследуемый материал и круговыми движениями распределяют тонким слоем по всей его поверхности. Мазки-отпечатки из органов и тканей получают прикасанием предметного стекла к срезанной стерильным скальпелем поверхности. На одном стекле делают несколько отпечатков.
Мазок высушивают на воздухе, затем фиксируют над пламенем горелки или в спирт-эфире (этиловый спирт + эфир 1:1) 20 мин, спирте с формалином (5 мл 40 %-ного формалина, 9,5 мл 96 %-ного этилового спирта) - 15 мин, ацетоне - 5 мин, хлороформе - несколько секунд.
Высушенные и зафиксированные мазки окрашивают по Граму, Цилю- Нильсену, Романовскому-Гимзе, Михину или другими методами. При выборе метода выделения и культивирования возбудителя учитывают анамнестические и эпизоотологические данные, результаты клинического исследования. Так, при наличии большого количества слизи на жабрах, спине, хвостовом плавнике проводят исследования на миксобактериоз. В этом случае делают высев на чашки Петри с цитофаг-агаром или МПЖ. Большинство возбудителей болезней рыб хорошо растут на обычных мясо-пептонных средах.
При выделении анаэробных культур из питательных сред удаляют растворенный кислород. Анаэробные условия создаются в средах, налитых высоким столбиком, покрытых слоем растительного масла толщиной 6-8 см (печеночный бульон, Среда Китта-Тароцци и др.). Для удаления растворенного кислорода жидкие питательные среды перед посевами кипятят в пробирках на водяной бане в течение 10 мин. Для создания анаэробных условий используют также анаэростат - воздух откачивают вакуумным насосом.
Выделение чистых культур микробов. Берут стерильную жидкость (бульон, физиологический раствор и т. п.) и готовят слегка опалесцирующую микробную взвесь, которую высевают на твердую питательную среду (МПА рН 7,2-7.6). Каплю посевного материала наносят на поверхность агара в чашке и распределяют стеклянным шпателем.
Можно применить дробный высев. Делают это так: на поверхность агара первой чашки наносят каплю агаровой взвеси, а затем петлей или шпателем (без добавления культуры) материал последовательно распределяют по нескольким чашкам. Засеянные чашки с агаром помещают на 24-48 ч в термостат, а чашки с желатиной оставляют при комнатной температуре, выросшие в чашках отдельные колонии просматривают под лупой или малом увеличении микроскопа, нужные отмечают и пересевают на питательные среды в пробирки. Чтобы убедиться в чистоте культуры, материал с одной колонии разбавляют в стерильной жидкости и вновь высевают на чашки с агаром.
Чистую культуру после макро- и микроскопической проверки изучают. Для этого исследуют ее морфологические, тинкториальные, культуральные, биохимические, серологические и биохимические свойства по схеме:
1) морфология (микроскопия окрашенных микробов);
2) подвижность (микроскопия микробов в живом состоянии методом висячей или раздавленной капли);
3) форма и расположение жгутиков (окраска препаратов);
4) отношение к окраске по Граму (грамположительные или грамотрицательные);
5) реакция на цитохромоксидазу (цв. табл. I,А);
6) споры (окраска препарата);
7) капсулы (окраска препарата);
8) бульон (прозрачность или мутность, пленка, осадок, цвет среды, запах);
9) скошенный агар (мощность роста - отсутствует, слабая, умеренная; характер роста - нитевидный, волнистый, мелкозубчатый, лопастной, ворсистый; блеск - влажный, жирный, тусклый; поверхность - гладкая, шероховатая, зернистая, складчатая, сухая, влажная; рельеф - плоский, выпуклый; прозрачность - непросвечивающийся, просвечивающийся, опалесцирующий; консистенция - маслянистая, тягучая, крошковатая; цвет посевной черты - пигментация; окраска среды - зеленая, сине-зеленая и т. д.);
10) колонии на агаре в бактериологических чашках (рост - скудный умеренный, обильный; величина - крупные, мелкие, точечные; форма - круглая, эллипсовидная, корневидная; структура - волокнистая, хлопьевидная; характер края - волнистый, ровный, изрезанный, бахромчатый, локонообразный и т. д.; цвет колонии - пигментация; окраска среды; запах - отсутствует, резкий, что напоминает);
11) желатина в бактериологических чашках (разжижена или нет; характер разжижения; дальнейшее описание морфологии колонии ведут как на агаре);
12) желатина, посев уколом (характер роста по уколу - в виде ленты, нити, гвоздя с головкой, равномерный, прерывистый, только поверхностный; разжижение - в виде чашечки, воронки, цилиндра, кратера, поверхностное, пузырчатое - в глубине; скорость разжижения - быстро, медленно; окраска среды - зеленая, синяя и т. д.);
13) лакмусовое молоко (реакция - кислая, щелочная, без изменений; ввертывание; сгущение; пептонизация);
14) картофель (интенсивность и характер роста, цвет пигмента);
15) ферментация углеводов (быстрота и степень кислото- и газообразования при росте на средах Гасса и Хью-Лейфсона);
16) образование ацетилметилкарбинола (к 1 мл 2-3-суточной культуры на среде Кларка прибавляют 0,5 мл 6 %-ного спиртового раствора альфанафтола и 1 мл 16 %-ного водного раствора NaOH. При положительной реакции через 3-5 мин среда приобретает вишневый цвет);
17) образование индола (экстрагирование индола путем прибавления 1-2 мл эфира к 3-5 мл 3-5-суточной культуры на мясо-пептонном бульоне или бульоне Хоттингера, затем прибавляют реактив Эрлиха-Боме, который в присутствии индола окрашивает вытяжку эфира в красный цвет);
18) образование сероводорода (фильтровальная бумага, смоченная раствором уксуснокислого свинца и фиксированная в пробирке с мясо-пептонным бульоном, сразу же после засева в присутствии сероводорода чернеет или буреет);
19) образование аммиака (фильтровальная бумага, заранее обработанная реактивом Несслера или Крупа и фиксированная в пробирке с только что засеянной средой, обычно уже через сутки инкубирования посевов в присутствии аммиака буреет или краснеет);
20) редукция нитратов (при редукции нитратов в нитриты получается темно-синее окрашивание 2-3-суточной бульонной культуры с 0,2 % калийной селитры в результате прибавления к культуре 10 %-ного водного раствора крахмала с йодистым калием и 10 %-ного водного раствора химически чистой серной кислоты);
21) гидролиз крахмала (на поверхность 0,2 %-ного крахмального агара в бактериологических чашках с 2-3-суточной культурой наливают насыщенный и профильтрованный раствор кристаллического йода в 50 %-ном спирте; при рассмотрении чашки в проходящем свете вокруг колоний бактерий расщепляющих крахмал, можно обнаружить светлые зоны);
22) редуцирующая способность (посев уколом в агар с метиленовой синькой и другими красками);
23) отношение к кислороду (выдерживают посевы в аэробных и анаэробных условиях);
24) гемолизируюшие свойства (посев на мясо-пептонный агар с 5-10 % дефибринированной крови барана, кролика или лошади);
25) температурный оптимум (определяют быстроту и интенсивность роста микробов, выдерживая посевы при различной температуре).
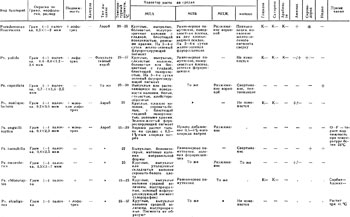
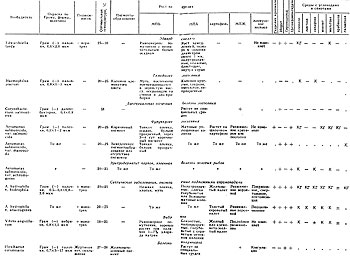
Культурально-морфологические и биохимические свойства некоторых бактерий - возбудителей болезней рыб представлены в таблицах 9, 10.
(Условные обозначения: грам (-) - грамотрицательные бактерии; грам (+) - грамположительные бактерии; "+" - реакция положительная; "-" - реакция отрицательная; "." - данных нет; ( + ) - реакция замедленная; КГ - ферментация с образованием кислоты и газа; К - ферментация с образованием кислоты; ± - признак варьирует.)
Определение чувствительности бактерий к антибиотикам. Чувствительность микроорганизмов к антибиотикам определяют методом диффузии в агар с применением стандартных бумажных дисков на плотных питательных средах (МПА и кровяном агаре). Стандартные диски диаметром 5 мм готовят на специальной фильтровальной бумаге, пропитанной антибиотиками и окрашенной в контрастные цвета (цв. табл. I-Б).
В стеклянные чашки Петри наливают 2 % МПА или кровяной агар толщиной 4-5 мм. Чашки слегка подсушивают в термостате. В зависимости от интенсивности роста исследуемой культуры ее используют после 1 - 3-суточного инкубирования при оптимальной температуре на МПА или МПБ. Из агаровых культур с помощью физиологического раствора готовят 10-6 бактериальную взвесь.
На поверхность подсушенной среды наносят несколько миллилитров исследуемой культуры, равномерно распределяют по поверхности среды, избыток культуры отсасывают пастеровской пипеткой. Через 30-40 мин на поверхность среды стерильным остроконечным пинцетом накладывают диски с антибиотиками, слегка придавливая к агару. Диски располагают на расстоянии 2-2,5 см один от другого и от края чашки. Чашки переворачивают вверх дном и помещают в термостат на 1-2 сут при температуре инкубирования, оптимальной для данного микроба.
Диффундируя в агар, антибиотик образует вокруг диска зону угнетения роста чувствительных к нему бактерий. Зоны угнетения измеряют полоской миллиметровой бумаги. Учитывают диаметр зоны, проходящей через центр диска: при диаметре зоны угнетения роста менее 11 мм - бактерии резистентные или слабочувствительные, 11-20 мм - чувствительные и более 20 мм - высокочувствительные.
|
ПОИСК:
|
© RIBOVODSTVO.COM, 2010-2022
При использовании материалов сайта активная ссылка обязательна:
http://ribovodstvo.com/ 'Рыбоводство'
При использовании материалов сайта активная ссылка обязательна:
http://ribovodstvo.com/ 'Рыбоводство'