
Оценка качества половых продуктов рыб люминесцентными методами (Хоменков А.С., ГГУ, Авдеев Б.В., НПО "Квант", Цвылев О.П., ВНИРО, Панченков Г.Т., форелевое хозяйство "Сходня") (УДК 639.371.1.)
Разработка методов оценки качества половых продуктов самок при искусственном разведении рыб - одна из важнейших задач рыбоводства. Известные в настоящее время способы не имеют необходимой точности. Нами предпринята попытка диагностики состояния ооцитов методами люминесцентного анализа, основанными на способности веществ светиться при воздействии на них каких-либо источников энергии и подразделяющимися на две группы - первичной, когда анализируется собственное свечение объекта, и вторичной люминесценции, когда в объект вводится флюоресцентный зонд. Последний способ особенно перспективен при исследовании биологических объектов, так как он позволяет определять конформационное состояние белковых структур и регистрировать происходящие в них изменения. Однако он несколько сложнее метода первичной люминесценции и подразумевает проведение большой поисковой работы, связанной с выбором наиболее подходящего флюоресцентного зонда для решения конкретной задачи. Поэтому первоначально нами была предпринята попытка экспериментально оценить возможность применения метода первичного люминесцентного анализа, тем более, что в литературе имеются данные о зависимости между интенсивностью люминесценции содержимого инкубируемой икры и качеством получаемого из нее потомства (Семенов, 1968).
Объектом исследований служили самки стальноголового лосося из Волгореченского форелевого хозяйства и радужной форели с форелевого хозяйства "Сходня". Сравнивали интенсивность люминесценции содержимого ооцитов IV стадии зрелости и овулировавшей икры.
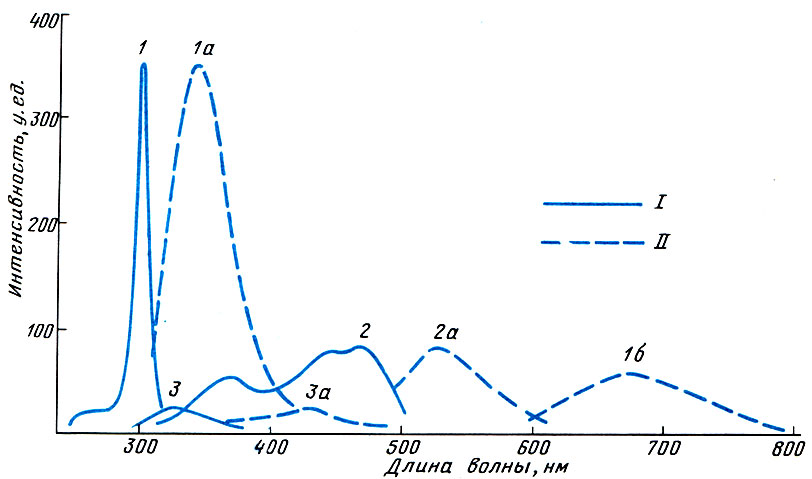
Спектр люминесценции содержимого ооцитов лососевых рыб: I - спектр возбуждения; II - спектр испускания (у.ед.- условные единицы; нм - нанометры)
Измерения интенсивности люминесценции проводили на спектрофлюориметре "Хитачи-650-60". Содержимое ооцитов разбавляли в 10 %-ном растворе NaCl в соотношении 1:10. Ооциты IV стадии зрелости извлекали из тела забитой самки после ее вскрытия. Овулировавшую икру отцеживали у зрелых самок. К месту измерения ее доставляли в термостатируемой камере при температуре тающего льда. Овулировавшая икра находилась в овариальной жидкости, а неовулировавшая - в сухом виде и в овариальной жидкости зрелых самок.
Максимумы люминесценции определяли путем ступенчатого сканирования всего рабочего диапазона спектрофлуориметра от 200 до 900 нм. Были найдены три максимума возбуждения и четыре максимума испускания (см. рисунок).
Сравнение интенсивности люминесценции содержимого ооцитов самок IV стадии зрелости с аналогичными показателями овулировавшей икры показало, что выход люминесценции на пиках 343 и 655 нм у овулировавшей икры в среднем на 40 % выше, чем у ооцитов самок IV стадии зрелости. На остальных пиках интенсивность люминесценции была приблизительно одинаковой у всех рыб. Ооциты IV стадии зрелости, которые перевозились в овариальной жидкости зрелых самок, имели показатель интенсивности люминесценции несколько выше, чем ооциты тех же самок, перевозимых в сухом виде. Это может быть связано с процессом дозревания ооцитов под действием стероидных гормонов, содержащихся в овариальной жидкости зрелых самок (время перевозки составляло несколько часов).
Предварительные эксперименты по индивидуальной оценке качества зрелых самок в зависимости от интенсивности люминесценции содержимого их яиц не выявили строгой зависимости. В то же время было отмечено снижение на 10-20 % интенсивности люминесценции на пиках испускания 343 и 655 нм у четырех- и шестигодовиков по сравнению с трехгодовиками.
Полученные нами предварительные данные указывают на перспективность использования люминесцентных методов при отборе качественных производителей. В то же время, на наш взгляд, следует обратить особое внимание на возможность применения для данных целей метода вторичной люминесценции, который, как показывает практика, дает более стабильные и надежные результаты при анализе биологических объектов. Кроме того, этот метод имеет то преимущество применительно к нашей задаче, что позволит проводить измерение на целых ооцитах без выделения их содержимого. В этом случае флоресцентный зонд будет связываться с клетками фолликулярного эпителия и поверхностным слоем цитоплазмы яйца. Именно эти образования играют большую роль в процессе роста, созревания и дегенерации ооцитов и претерпевают значительные изменения (Гончаров, 1977; Фалеева, 1979). Вместе с тем следует отметить, что применение метода вторичной люминесценции подразумевает проведение большой предварительной поисковой работы, направленной на выделение из большого числа имеющихся зондов. Для решения данной задачи необходимо будет провести детальные цитобиохимические исследования изменений фолликулярного эпителия, происходящие при переходе ооцита из IV незавершенной в IV завершенную стадию зрелости и при ранних дегенеративных изменениях в нем. После проведения этих исследований и отработки методических тонкостей определение качества производителей станет процессом, не требующим высокой квалификации работников рыбхозов.
|
ПОИСК:
|
© RIBOVODSTVO.COM, 2010-2022
При использовании материалов сайта активная ссылка обязательна:
http://ribovodstvo.com/ 'Рыбоводство'
При использовании материалов сайта активная ссылка обязательна:
http://ribovodstvo.com/ 'Рыбоводство'