
Беседы по гидрохимии
Подготовка воды и изменение гидрохимических показателей (Хомченко И.Г., доцент, канд. хим. наук)
Обычно для заполнения аквариума используется водопроводная вода. Конечно, перед этим аквариумист должен узнать гидрохимические характеристики, и в первую очередь жесткость и кислотность. Знание этих параметров определяет выбор рыб и растений.
Во многих случаях аквариумисту приходится изменять химический состав воды: увеличивать или уменьшать жесткость, соленость, кислотность. О том, как это надо правильно делать, мы расскажем сегодня.
Умягчение воды
При содержании и разведении некоторых водных организмов требуется мягкая вода (часто значительно более мягкая, чем в данной местности). Химические способы умягчения воды, основанные на внесении в нее различных реактивов, не подходят для аквариумистов, так как в результате удаления одних веществ (солей кальция и магния) в воде появляются другие, вредные для рыб и растений.
В предыдущей статье мы говорили о дождевой воде, которую после соответствующей очистки можно применять в качестве источника мягкой воды.
Простой способ снижения жесткости воды - кипячение. Однако надо помнить, что кипячение позволяет удалить (или снизить) лишь карбонатную жесткость (dKH). При этом чем дольше будет кипятиться вода, тем в большей степени произойдет снижение карбонатной жесткости. Однако вода, полученная в результате длительного кипячения, может иметь достаточно большую жесткость (за счет постоянной жесткости dNKH), но нейтральную или слабокислую реакцию, так как из нее удалены гидрокарбонаты, сообщающие воде щелочные свойства. Этот способ не дает существенного умягчения воды.
Эффективным способом умягчения воды является вымораживание, которое может быть применено при наличии морозильника достаточного объема или в зимнее время. Вымораживание можно проводить в эмалированной или пластмассовой посуде (пластмасса должна быть морозостойкая): воду заливают в сосуд и выставляют на мороз. После того, как замерзла примерно половина ее, пробивают ледяную корку, сливают остатки жидкости (она стала содержать больше солей), а лед растапливают, получая достаточно мягкую воду. В зависимости от исходной жесткости после вымораживания значение dGH обычно составляет 1-3°.
Один из лучших способов получения мягкой воды - дистилляция, причем чем более совершенно приспособление для ее проведения, тем полнее обессоливается вода. В химических лабораториях используют электрические дистилляторы (например, ДЭ-4), имеющие высокую производительность.
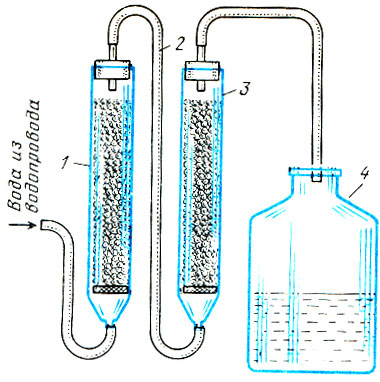
Рис. 1. Установка для дистилляции (перегонки) воды: 1 - колба с исходной водой; 2 - холодильник; 3 - аллонж; 4 - сосуд для сборка дистиллята
Дистилляция основана на испарении воды с последующей конденсацией ее паров на холодном теле. На рис. 1 показана лабораторная установка для дистилляции (перегонки) воды, которую может собрать и аквариумист. В колбу наливают воду и помещают несколько кусочков битого фарфора (для более равномерного кипения). Для лучшей очистки можно добавить по нескольку капель растворов перманганата калия (до слаборозового цвета) и серной кислоты. Колбу закрывают пробкой с термометром. Через водяной холодильник пропускают проточную холодную воду. Дистиллированная вода собирается в сборное емкости. Колбу с исходной водой нагревают на газовой горелке или электроплитке.
Значительно производительнее метод обессоливания воды с применением ионообменных смол (ионитов). Он также может быть реализован аквариумистами в домашних условиях, поэтому расскажем о нем подробнее.
Иониты - органические вещества, содержащие подвижные ионы (катионы или анионы), которые могут обмениваться с катионами (эти иониты называются катионитами) или анионами (аниониты) электролита, в данном случае - воды.
Для аквариумистов мы рекомендуем использовать катиониты КУ-2, КУ-23 и аниониты АВ-17 или др.
Прибор для определения воды - ионообменную колонку можно изготовить из стеклянных или пластмассовых трубок диаметром 3-6 и длиной 40-60 см. Понадобятся две такие трубки - отдельно для катионита и анионита. С помощью резиновых или пластмассовых трубочек и переходников собирают установку, изображенную на рис. 2.
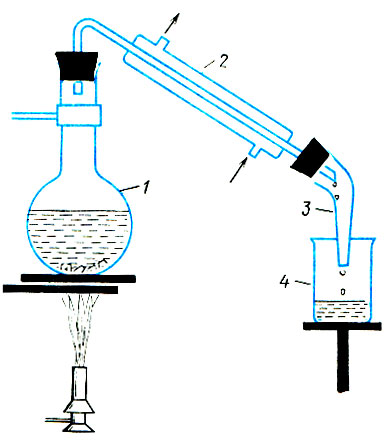
Рис. 2. Установка для обессоливания воды при помощи ионитов: 1 - колонка с катионитом; 2 - соединительный шланг; 3 - колонка с анионитом; 4 - сосуд с обессоленной водой
Иониты перед заполнением колонок должны быть подготовлены. Вначале их заливают водой на 10-12 ч для набухания, затем через катионит, насыпанный в колонку, пропускают 5 %-ный раствор серной или соляной кислоты из расчета 400 мл раствора на 100 г сухого катионита. Затем его промывают дистиллированной водой (объемом в 2 раза большим, чем объем кислоты).
Анионит после набухания помещают в другую колонку, обрабатывают 5 %-ным раствором щелочи (гидроксид натрия NaOH или калия КОН) из расчета 300 мл раствора NaOH (или 400 мл раствора КОН) на 100 г сухого анионита и промывают дистиллированной водой (объемом в 2-3 раза большим, чем объем щелочи). После этого систему собирают и готовят к работе.
Какое количество дистиллированной воды можно получить в такой системе без регенерации? Это определяется количеством ионитов и их обменной емкостью. Так, если на заполнение колонок пошло по 100 г катионита КУ-2 (КУ-23) и анионита АВ-17 (в расчете на сухую массу), то с помощью такой установки можно обессолить до 100 л воды с жесткостью около 10° dGH. Если исходная вода мягче, то объем получаемой без регенерации воды пропорционально возрастает, и наоборот.
Для регенерации ионитов колонки отключают от установки, затем обрабатывают их содержимое так же, как это было описано выше, но без набухания. В нерабочем состоянии колонки надо хранить заполненными дистиллированной водой.
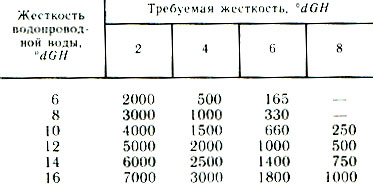
Итак, мы рассмотрели основные методы получения обессоленной или дистиллированной воды. Как надо использовать ее для приготовления воды с заданной жесткостью? В таблице показано, сколько миллилитров дистиллята надо смешать с 1 л жесткой (водопроводной) воды, чтобы получить определенное значение dGH.
Повышение жесткости и солености воды
Жесткость воды можно повысить, растворяя в ней различные вещества. Проще всего увеличить постоянную жесткость. Для этого мы рекомендуем приготовить 10 %-ный раствор хлорида кальция (он продается в аптеках) и 10 %-ный раствор сульфата магния (MgSO4·7H2O - основной компонент горькой соли, которая также продается в аптеках). Для повышения жесткости на 1° dGH надо в 100 л воды растворить 18,3 мл 10 %-ного раствора СаСl2 или 19,7 мл 10 %-ного раствора MgSO4. Мы рекомендуем добавлять их примерно в одинаковых количествах для поддержания необходимого рыбам и растениям соотношения ионов кальция и магния.
Несколько сложнее повысить карбонатную жесткость воды. В некоторых руководствах предлагается положить в воду карбонатные породы (мел, мрамор, доломит и др.). Однако надо помнить, что растворение их в воде происходит лишь в присутствии углекислого газа СO2:
СаСO3+СO2+Н2O=Са(НСO3)2.
Источником СO2 обычно служат рыбы, плотность посадки которых должна быть достаточно высокой. При использовании этого способа повышения жесткости надо помнить, что для увеличения dKH на 1° в 100 л воды должно раствориться 1,8 г карбоната кальция СаСО3 или 1,5 г карбоната магния MgCO3. Лучше брать обе соли примерно в равных количествах.
Для содержания рыб (живородящие, тетрадоны и др.) и некоторых других водных животных требуется вода не только жесткая, но и имеющая достаточно высокую общую соленость. Обычная рекомендация, часто встречающаяся в книгах по аквариумистике, - добавлять в воду поваренную соль (NaCl). Этот способ не самый удачный. Во-первых, мы, увеличивая концентрацию ионов (Na+ и Сl-, нарушаем общее соотношение ионов в воде. Во-вторых, избыток ионов натрия неблагоприятно сказывается на развитии многих аквариумных растений. Поэтому рекомендуем аквариумистам для повышения общей солености воды использовать смеси солей (сульфатов и хлоридов) натрия и калия, например, NaCl+K2SO4 или Na2SO4+KCl (1:1). Для расчета требуемого количества каждой соли надо знать: чтобы повысить соленость 100 л воды на 1 г/л (или 1000 мг/л), в ней растворить 100 г смеси указанных солей.
Изменение кислотности воды
Аквариумисту часто приходится сталкиваться с необходимостью изменения pH в аквариумной воде. Однако, как правило, это свойство является вторичным, во многом зависящим от жесткости: обычно, как говорилось ранее, более жесткая вода - щелочная, более мягкая - кислая. Существуют способы химического воздействия на воду, позволяющие немного увеличить или уменьшить pH. Следует помнить, что эти изменения часто непродолжительны (через некоторое время система возвращается в исходное состояние), поэтому необходим постоянный контроль pH.
Увеличить кислотность (уменьшить pH) можно, вводя в аквариумную воду растворы кислот: фосфорной, уксусной, серной, соляной. Добавлять кислоту к воде надо очень осторожно (по каплям). Лучше взять 1-2л воды из аквариума, добавить несколько капель раствора кислоты, вылить воду обратно. Если будет необходимость, то операцию можно повторить.
Хороший способ подкисления воды - добавление соли, которая имеет кислую реакцию из-за процесса гидролиза (взаимодействия с водой). Такими солями являются дигидрофосфат натрия NaH2PO4 и дигидрофосфат калия КН2РO4. Воду с слабокислой реакцией (pH от 5,8 до 6,5 в зависимости от жесткости) можно получить, растворив 20-30 г одной из названных солей в 100 л аквариумной воды.
Достаточно мягкую (например, обессоленную или дистиллированную) воду можно подкислить отваром торфа. Для этого 10-20 г верхового торфа кипятят в 1 л дистиллированной воды в течение получаса. Охлажденный отвар отфильтровывают и хранят в холодильнике. Отвар добавляют в мягкую воду до приобретения ею золотистой окраски.
Верховой торф можно также использовать в качестве наполнителя для аквариумных фильтров, если необходимо получать мягкую, кислую воду и поддерживать ее в таком состоянии. С использованием торфяного наполнителя можно в течение двух-трех дней превратить воду очень высокой жесткости (20° dGH и более) в мягкую (менее 4°). Установку торфяного фильтра можно сочетать с добавлением в воду веществ с кислой реакцией.
Для подщелачивания воды (увеличения pH) лучше всего использовать не щелочи (NaOH, КОН, Са(ОН)2), а вещества, имеющие щелочную реакцию в результате гидролиза, например, гидрофосфат натрия Na2HP04, гидрофосфат калия К2НРO4, гидрокарбонат натрия (питьевая сода) NaHCO3. Для получения воды со слабощелочной реакцией в 100-литровом аквариуме надо растворить 3-8 г одной из названных солей (а лучше - смесь солей натрия и калия).
|
ПОИСК:
|
© RIBOVODSTVO.COM, 2010-2022
При использовании материалов сайта активная ссылка обязательна:
http://ribovodstvo.com/ 'Рыбоводство'
При использовании материалов сайта активная ссылка обязательна:
http://ribovodstvo.com/ 'Рыбоводство'