
Влияние различной продолжительности выдерживания самок карпа при нерестовой температуре воды на цитоморфологическое состояние ооцитов фазы Е (Т. П. Албаева, А. С. Толстоногов)
УДК 597.554.3 - 14
Литературные данные о характере первичных этапов атрезии овариальных фолликулов карповых рыб несколько противоречивы (Казанский, 1949; Сакун, 1957; Фалеева, 1965; Статова, 1968; Зеленин, 1971; Володин и др., 1974; Ефимова, 1977, и др.). Расхождения в описании цитоморфологической картины разными исследователями, очевидно, обусловлены специфическими видовыми особенностями начальных этапов атрезии ооцитов у карповых рыб.
Целью наших исследований являлось гистологическое изучение яичников самок карпа после различной длительности выдерживания рыб в условиях нерестовой температуры воды и определение первоначальных морфологических изменений в ооцитах фазы Е.
Материал и методика. Исследования проводили в рыбхозе "Сускан" Куйбышевской области в 1976 - 1979 гг. Объектом изучения являлись самки местного беспородного карпа. В мае - июне до опытов рыб содержали при 6 - 14°С.
В общей сложности для экспериментальных работ использовали 140 самок. В каждой серии опытов было по 20 особей, которых распределяли на группы по схеме:
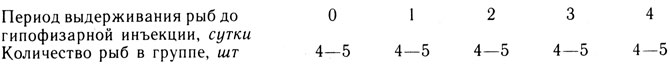
Производителей выдерживали при температуре воды 19 - 20°С. У каждой рыбы из середины левого яичника брали пробы овариальной ткани по методу биопсии (Леманова, Сакун, 1975). Эту операцию производили при введении первой гипофизарной инъекции самкам. Собранный материал фиксировали в жидкости Буэна и обрабатывали по общепринятым гистологическим методикам. Срезы толщиной 5 - 7 мкм окрашивали железным гематоксилином по Гейденгейну (Роскин, Левинсон, 1957 и др.). Рисунки с препаратов готовили при помощи рисовально-проекционного аппарата РА-6 при увеличении об. 8×, ок. 7×. При гистологическом анализе основное внимание обращали на состояние ядерного аппарата, цитологических включений и оболочек ооцитов, придерживаясь периодизации атрезии овариальных фолликулов для карповых рыб, разработанной Т. И. Фалеевой (1979).
Результаты исследований и обсуждение. Цитоморфологический анализ ооцитов фазы Е, взятых щупом при гормональной стимуляции созревания самок не показал каких-либо изменений по сравнению с исходным состоянием в первые двое суток выдерживания рыб. Это наблюдалось на протяжении мая - начала июня 1976 г. Разнообразие в состоянии и положении ядер в ооцитах несколько увеличилось через трое суток. К этому времени во многих ооцитах происходило смещение ядер к оболочкам и завершался процесс концентрации ядрышек. После четырех суток в большинстве ооцитов наблюдались "гипертрофированные" или вытянутые ядра. В одних гипертрофированных ядрах происходил процесс вакуолизации сконцентрированных в центре ядрышек, в других мелкие ядрышки рассеяны по всей кариоплазме, третьи были оптически пустыми. Основная масса таких ооцитов на срезах имела разреженную концентрацию желточных гранул в центральной зоне, что очевидно, явилось результатом лизиса кортикальных альвеол и оттеснения их содержимым гранул желтка в периферии ооцитов (см. рисунок, а).
Во второй половине мая 1978 г. уже после двух суток выдерживания самок в яичниках отмечалась группа ооцитов с ядрами, вытянутыми в дейтоплазме или находящимися под оболочками половых клеток с растворяющейся ядерной мембраной (см. рисунок, б). При дальнейшем выдерживании рыб в большом количестве встречались также ооциты с центрально расположенными ядрами. В начале июня у отдельных самок даже без выдерживания их при нерестовой температуре воды в ооцитах отмечалось смещение ядер к оболочкам, при этом концентрация ядрышек уже завершилась и начался процесс их вакуолизации. Встречались также ооциты с ядрами, оптически пустыми и вытянутыми в дейтоплазме (см. рисунок, в). При выдерживании рыб в течение суток в большинстве ооцитов имелись гипертрофированные центрально расположенные ядра, в которых происходило слияние ядрышек и наблюдался процесс их вакуолизации. Одновременно в отдельных ооцитах отмечались миграция и разрушение кортикальных альвеол, их содержимое в незначительных количествах сосредоточивалось на небольших участках под радиальной оболочкой (см. рисунок, г). В некоторых ооцитах просматривались гипертрофированные оптически пустые ядра, расположенные вблизи микропиле.
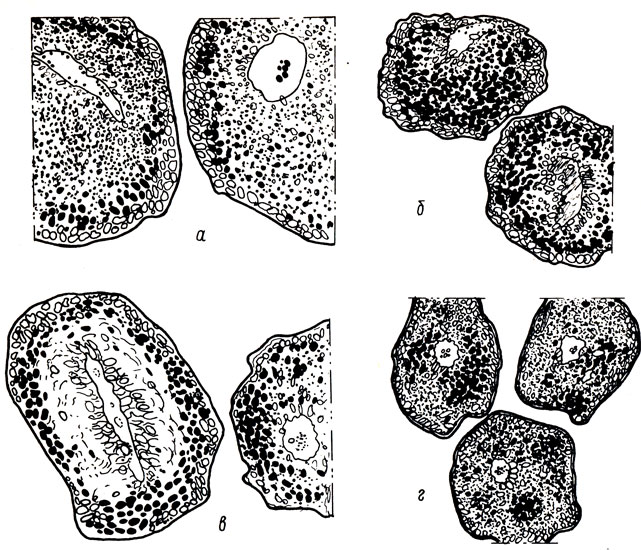
Дегенерирующие ооциты фазы Е у карпа (описание см. в тексте): а - поляризованный ооцит с гипертрофированным ядром, в котором произошла концентрация ядрышек и начался процесс их вакуолизации; б - поляризованные ооциты с вытянутыми в дейтоплазме ядрами, в которых происходит разрушение ядрышек; в (6) - ооциты с измененной конфигурацией ядра в центральном его положении. Содержимое разрушенных кортикальных альвеол оттесняет гранулы желтка к периферии; г - ооциты с ядрами, в которых произошла концентрация ядрышек и наблюдается процесс их вакуолизации. Перемешивание цитоплазматических включений
Таким образом, наши экспериментальные исследования показали, что при увеличении продолжительности выдерживания самок карпа в условиях температуры воды, превышающей нижний порог для нереста, значительно возрастает разнообразие в состоянии и положении ядерного аппарата. Так, выдерживание рыб от 2 до 4 суток приводило к увеличению количества клеток с полностью смещенными к оболочкам ядрами в среднем от 10 до 25%. За это время число ооцитов со смещенными на 1/4 радиуса клеток ядрами, а также с центральным их положением возрастало от 25 до 29%. Увеличение количества неполяризованных ооцитов, очевидно, связано с усилением трофоплазматического роста ооцитов последующих "микрогенераций", которые периодически пополняли фонд клеток фазы Е.
Смещение ядер в другой группе ооцитов, достигших предельных размеров, происходило, возможно под действием гонадотропинов, экскрети-руемых небольшими дозами, собственными гонадотропоцитами рыб.
В процессе наших исследований обнаружены дегенеративные изменения ядер, расположенных в центральной зоне ооцитов фазы Е. Эти изменения характеризуются следующей направленностью: концентрация ядрышек, их вакуолизация и разрушение, "гипертрофия" ядра, изменение его конфигурации и пикноз. У части половых клеток этой же фазы развития аналогичные изменения в ядрах обнаружены, когда они смещены к анимальному полюсу.
Сопоставляя литературные (Статова и др., 1982) и собственные данные, можно сказать, что начальные морфологические выраженные дегенеративные изменения ооцитов фазы Е у карпа, очевидно, связаны с перемешиванием цитоплазматических включений и почти одновременным повреждением ядра.
У карпа процесс атрезии отдельных овариальных фолликулов носит асинхронный характер. Увеличение размера клеток фолликулярного эпителия и разрушение радиальной оболочки проявляются у карпа гораздо позднее. Нам не удалось наблюдать эти этапы атрезии у большого количества ооцитов, так как резервирование рыб проводилось до опытов при температуре воды не выше 13 - 14°С, что обусловило относительно невысокую интенсивность обменных процессов в организме. Сравнительно кратковременное (до четырех суток) выдерживание самок при температуре воды 19 - 20°С также не доводило процесс дегенерации ооцитов фазы Е до этих этапов.
Литература
Володин В. М., Межнин Ф. И., Кузьмина В. В. 1974. Экспериментальное изучение резорбции икры леща Abramis brama L. - Вопр. ихтиологии, 14, 2.
Ефимова Т. А. 1977. Влияние теплых сбросных вод Конаковской ГРЭС на половые циклы рыб Иваньковского водохранилища. - В кн.: Биологический режим водоемов-охладителей ТЭЦ и влияние температуры на гидробионтов. М.
Зеленин А. М. 1971. Половой цикл и плодовитость белого амура (Ctenopharyngodon idella V.), акклиматизируемого в прудах Молдавии. - В сб. Биологические ресурсы водоемов Молдавии, 9, Кишинев.
Казанский Б. Н. 1949. Особенности функций яичника и гипофиза у рыб с порционным икрометанием. - Труды Лаб. основ рыбоводства. 2, Л.
Леманова Н. А., Сакун О. Ф. 1975. Методическое пособие по гормональной стимуляции производителей карпа при раннем получении личинок. Л., Изд. ГосНИОРХ
Роскин Г. И., Левинсон Л. Б. 1957. Микроскопическая техника. М.
Сакун О. Ф. 1957. Анализ состояния половых желез у сырти, проходящей через Кегумский рыбоход. - Учен. зап. ЛГУ, 228, сер. биол. наук, 44, 1.
Статова М. П. 1968. Анализ годичного цикла яичников серебряного карася. - В сб.: Биол. ресурсы водоемов Молдавии, 5, Кишинев.
Статова М. П., Таликина М. Г., Калинин Р. А. 1982. Физиолого-биохимическая характеристика икры карпа Cyprinus carpio L. (Cyprinidae) в условиях заводского воспроизводства. - Вопр. ихтиологии, 22, 3.
Фалеева Т. И. 1965. Анализ атрезии овоцитов у рыб в связи с адаптивным значением этого явления. - Вопр. ихтиологии, 5, 3.
Фалеева Т. И. 1979. Сравнительный и экспериментальный анализ нарушений оогенеза у рыб. Автореф. канд. дис. Л.
|
ПОИСК:
|
© RIBOVODSTVO.COM, 2010-2022
При использовании материалов сайта активная ссылка обязательна:
http://ribovodstvo.com/ 'Рыбоводство'
При использовании материалов сайта активная ссылка обязательна:
http://ribovodstvo.com/ 'Рыбоводство'